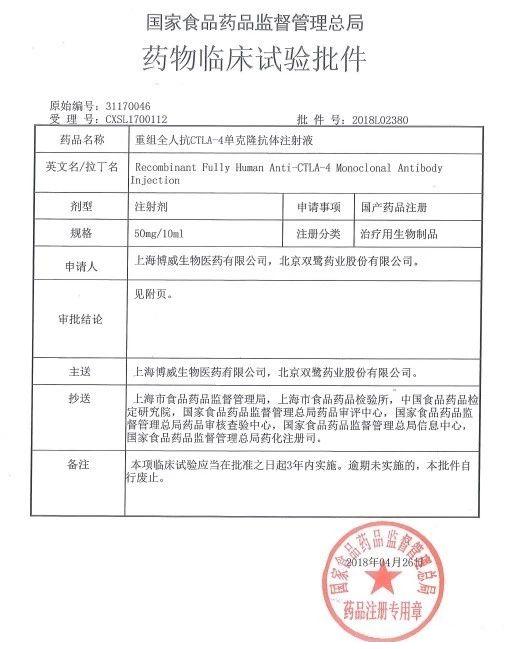
“重组全人抗CTLA-4单克隆抗体注射液” 是靶向被动免疫治疗肿瘤的有效药物,可激活免疫系统,将用于治疗晚期黑色素瘤。其原研药是百时施贵宝(BMS)的Ipilimumab,商品名Yervoy?,是一种全人源IgG1-κ单克隆抗体,能结合细胞毒性T细胞抗原-4(CTLA-4)分子,并阻断CTLA-4与CD80和CD86的相互作用。CTLA-4会影响人体的免疫系统,削弱其杀死癌细胞的能力,而Ipilimumab的作用机制是帮助人体免疫系统识别、从而增强T细胞活性,瞄准并攻击黑色素瘤癌细胞。新英格兰医学杂志曾报道目前炙手可热的PD-1抑制剂Nivolumab联合Ipilimumab治疗,在晚期黑色素瘤中喜人的结果。Yervoy?于2011年3月在美国批准上市,是第一个免疫检查点药物,也是第一个被美国FDA批准的用以转移黑色素瘤治疗的药物,其2017年的全球销售额达到12.44亿美元,目前未进入中国市场,国内也未有同品种上市,由于其与PD-1联合用药治疗的临床疗效,销售额预期不俗。
“面对众多研发单位的PD-1、PD-L1抑制剂等免疫检查点药物的研发,北京双鹭提前布局抗CTLA-4单抗,极具前瞻眼光”,博威生物创始人、总裁王少雄博士表示,“博威生物能够为北京双鹭提供创新单抗药物全程一站式的CRO服务并零发补顺利获得临床批件,展现了博威生物CRO服务团队的实力、魄力和执行力。我们始终坚持质量是企业的生命线,以客户诉求为导向,以研发质量为追求,以专业流程服务客户,共同建立和发展稳固的合作关系。”
“我们团队非常荣幸能够承担抗CTLA-4单抗的临床前研究,”苏州华测生物总经理陆国才先生表示,“华测生物虽然是比较新的临床前研究机构,但我们团队的安评经验还是很丰富的,为药企的创新药临床前研究设计符合科学性又可实施性的方案,我们有非常多的成功案例,博威生物是我们的战略合作伙伴,双方将鼎力合作,共同为大分子药物研发委托单位提供更多更好的‘一站式’服务。”
关于华测生物
苏州华测生物技术有限公司(简称“华测生物”)是由华测检测认证集团股份有限公司(股票代码:300012)投资的新药临床前研究技术外包服务企业。华测生物于2016年2月一次性通过国家食品药品监督管理总局(CFDA)药物GLP认证,2017年9月获中国合格评定国家认可委员会(CNAS)认可;2017年11月获国际实验动物评估和认可委员会(AAALAC)完全认证。在严格遵守CFDA和FDA的GLP规范和相关科学技术标准及指导原则基础上,华测生物主要为国内外医药企业、科研机构的新药开发提供早期筛选、成药性评价和药物的临床前药效学、药代动力学、安全性评价和毒代动力学研究技术“一站式”服务。
关于上海博威生物
上海博威生物医药有限公司(简称“博威生物”)由“千人计划”专家王少雄博士于2014年创立,是一家致力于打造生物药物研发、中试、生产等一站式服务平台,提供生物药物全产业链服务的高科技公司,可为国内外客户提供各类单抗药物的CRO/CDMO服务。作为上海市高新技术企业,博威生物拥有多项核心技术,数十项自主知识产权,构建了自身技术壁垒,公司研发设备投入总计逾亿元,研发团队近百人。公司创业管理团队均来自国际尖端生物制药企业,在单抗和生物大分子药物研发领域至少拥有20年以上工作管理经验、15年以上CRO服务和客户管理经验以及国内外几十个单抗项目主导研发的宝贵实战经验。